读懂天然产物系列——共生菌
发布日期:2016-06-14 22:25
来源:网络
作者:网络
浏览次数:
以下文章转载自小木虫海子017
引言
大小生物之间的互惠共生是大自然中的最普遍现象之一。漫长的共进化“特化”了与大生物共生微生物(简称“共生菌”)的生物合成过程。共生菌往往拥有特殊的代谢途径,故很有可能产生结构全新的生理活性物质,为此现在已成天然产物学者研究热点。
由于本人也不是学习内生菌的,对此部分内容了解不多。从我们的波大神给我一次评论的机会以来,自己选择了谭老师今年刚发的OL的文章开始学习。这几个星期对此学习点内容,跟大家共享。欢迎大家一起来讨论学习。首先我们来了解几个基本概念。
1、内生菌(endophyte):指在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官的细胞间隙或细胞内的细菌,可通过组织学方法或从严格表面消毒的植物组织中分离或从植物组织内直接产生扩增出微生物DNA的方法来证明其内生。(来源于百度百科)
2、植物内生菌:顾名思义就是生活在植物的组织或器官内的真菌或细菌内生菌。普遍存在于高等植物中,木本、草本植物,单子叶植物和双子叶植物内均有内生细菌。目前已成为生物防治中有潜力的微生物农药、增产菌或作为潜在的生防载体菌而加以利用。(来源于百度百科)
3、目前内生菌分为内生真菌(Endophytic fungi)、内生细菌(Endophytic bacteria)、内生放线菌(Endophytic actinomyces)。
文献
第一篇:Han, W. B., Lu, Y. H., Zhang, A. H., Zhang, G. F., Mei, Y. N., Jiang, N., Tan, R. X. Curvulamine, a New Antibacterial Alkaloid Incorporating Two Undescribed Units from a Curvularia Species. Org. Lett., 2014, 16 (20), 5366–5369
第二篇:Liu, J. Y.; Huang, L. L.; Ye, Y. H.; Zou, W. X.; Guo, Z. J.; Tan, R.X.J. Appl. Microb. 2006, 100, 195㈢ 2.
第三篇:Shen, L.; Jiao, R. H.; Ye, Y. H.; Wang, X. T.; Xu, C.; Song, Y. C.;Zhu, H. L.; Tan, R. X.Chem.Eur. J.2006, 12, 5596560
第四篇:Zhang, Y. L.; Ge, H. M.; Zhao, W.; Dong, H.; Xu, Q.; Li, S. H.;Li, J.; Zhang, J.; Song, Y. C.; Tan, R. X.Angew. Chem., Int. Ed.2008, 47,58235826
第五篇:Zhang, Y. L.; Zhang, J.; Jiang, N.; Lu, Y. H.; Wang, L.; Xu, S. H.;Wang, W.; Zhang, G. F.; Xu, Q.; Ge, H. M.; Ma, J.; Song, Y. C.; Tan,R. X.J. Am. Chem. Soc. 2011, 133, 59315940.
第六篇: Fang, W.; Ji, S.; Jiang, N.; Wang, W.; Zhao, G. Y.; Zhang, S.; Ge,H. M.; Xu, Q.; Zhang, A. H.; Zhang, Y. L.; Song, Y. C.; Zhang, J.; Tan,R. X.Nat. Commun.2012, 3, 1039.
第七篇:Tan, R. X., & Zou, W. X. Endophytes: a rich source of functional metabolites. Natural product reports, 2001.18(4), 448-459.
第八篇:Zhang, H. W., Song, Y. C., & Tan, R. X.. Biology and chemistry of endophytes. Natural product reports, 2006.23(5), 753-771.
【研究内容】
从白姑鱼(white croaker)的肠中分离到一株植物内生菌Curvularia sp. IFB-Z10。进一步对此内生菌进行培养和发酵,谭老师2006年(文献二)就从中分离一个新的有机酸(Compoud 1),以及大环单端单端孢霉烯类化合物、生物碱,见下图1。Compound 1 为一简单的有机酸的新化合物,我猜想很多同学分到这样子的化合物,估计看了H谱就放弃解谱了。此篇为其基础,终于于今年白姑鱼出了OL的大作(文献一)。本次评论重点评述此篇文献。
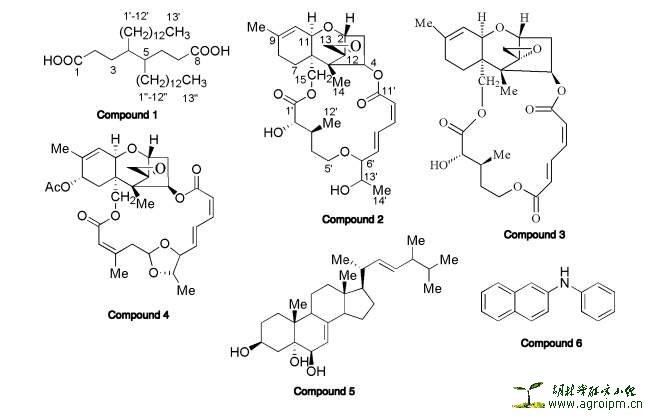
图1 文献二中分离到的化合物
【1、本文研究思路】

从植物内生菌Curvularia sp. IFB-Z10中分离到一个全新的骨架Curvulamine,作者对此进行了详细的结构解析,利用Cu靶衍射和ROESY确定了立体构型。并做了抗病毒活性评价。然后通过同位素示踪、再培养方法,推断了Curvulamine的生物合成途径。
【2、前言Introduction 】
作者开头首句就引用2011的Nature的文献,表明由于病源微生物日益进化,然而抗生素类药物研究滞后,人类健康面临威胁。因此urgent need 新型的抗菌药物。然后作者顺理地引出了前期研究基础和本文研究对象(白姑鱼)。
第1句:rapidly developed…prescribed… 个人觉得两个词用的很好,相对立。更加显示出urgent need。
第2句:emerging (or re-emerging) 用词准确。等等其他语言,一篇好的文章肯定经过各种斟酌。大家以后都可以关注一下,但凡高分文章,用词多为准确。
【3、结构解析】
正常的套路来写作的。但是一段作者利用双键的耦合常数(J= 12.0 Hz)判断出双键存在在脂肪族长链中或者大于7环中。个人知识疏浅,此处不明白。于是查阅了波谱解析课本(有机化合物的波谱解谱,药明 译)。现截图如下。

另外结构复杂,作者写作解析时画出的各个判断片段(a-f),让读者看的清楚明白。这一点可以学习一下。

此外一点是H-12位于吡咯环的反磁性的区域(屏蔽效应)。作者进一步引用了前期发表在JACS和Angew.Chem.的文章(见这两篇文献评述)。立体构型的确定是利用ROESY谱和Cu靶衍射(只听说过,没自己弄过,不懂。欢迎懂得大神普及知识)。
【4. 活性评价】
做了抗病毒活性评价,结果显示MCIs=0.37μM。做天然产物化合物的活性评价的童鞋应该都知道,天然产物活性能做到μM的浓度级别不多。较比阳性药(tinidazole,甲硝磺酰咪唑),显示出活性较好。然而更特别地是,Curvulamine的抗菌活性比阳性药更有选择性,显示无抗真菌活性。
【5. 生物合成途径的推导—文章亮点】
生物合成途径是做天然产物发文章最头痛的问题!需要专业扎实的有机合成知识(读懂天然产物系列欢迎有机各位大神加入,针对常见天然产物骨架的合成提出建设性看法)。
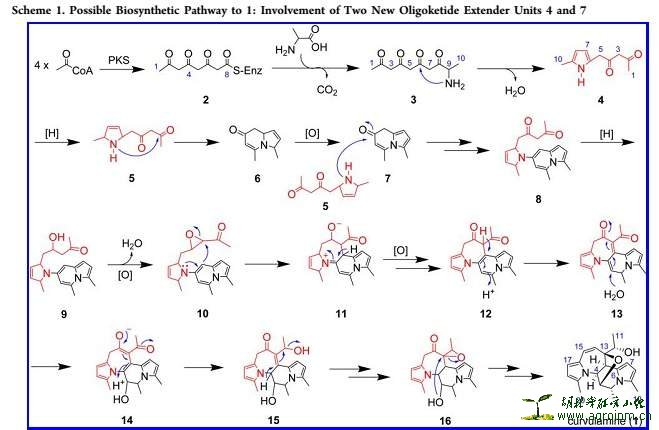
【亮点1】. 生物合成途径前体是乙酰辅酶A(acyl CoA)和丙氨酸
本人第一次看此文章,想作者怎么就想想到乙酰辅酶A和一个常见的氨基酸为一个新的骨架的合成前体。后来,看参考文献里面引用了谭老师自己课题组的文章,才发现这不为惊讶(referenc-5,6,7 见后面评述)。前期奠基了扎实的基础。另外也说明了利用文献追踪文献的重要性!
【亮点2】. 利用同位素示踪、菌种再培养、酶抑制活性和13C-NMR技术验证了生物合成途径
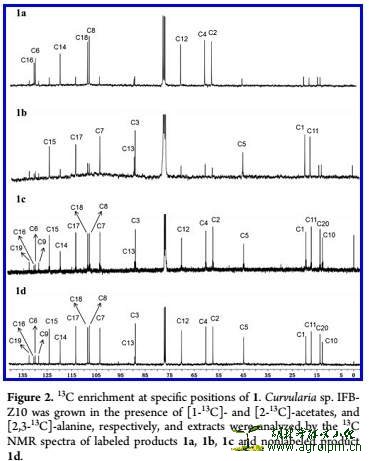
首先作者巧妙地将C-1和C-2用13C标记的乙酸钠盐(CH3COONa)分别加入菌种中,再分别的重新培养、发酵、分离、鉴定,发现两者的分别相隔地一些C信号增强(见图1a和1b)。然而C-9、C-10、 C-19、C-20的四个碳信号并未增强。
作者进一步研究,根据文献推测可能与丙氨酸(alanine)有关。继续在菌种加入C-2和C-3都13C标记的丙氨酸(CH3-CH(NH2)-COOH),最后发现C-9、C-10、 C-19、C-20的四个碳信号都增强。神奇地是,其他位置的C信号也增强了!作者再根据文献和13C-13C耦合验证了C-2和C-3都13C标记的丙氨酸能够代谢变化成C-1和C-2都13C标记乙酸盐(恰恰是前面验证的合成前体)。(见图1c)。
为此作者想到了利用酶抑制反应来验证猜想。这里真心佩服下作者和课题组团体的清晰的思路和巧妙的文章布局。(题外话:遇到问题后,我们应该去想为什么出现,或者是课题创新的一大点。这里我想到了本评述系列之4-“变型”金刚:绝迹重生【链接:http://emuch.net/bbs/viewthread.php?tid=7676565&fpage=2】),欢迎大家再去关注下这个帖子,发表自己的想法。经典之帖)。回到正题,D-环丝氨酸(D-Cycloserine)能够抑制氨基酸和乙酰辅酶A的聚合,发现在此浓度1.0 mM时,菌种培养不能产生Curvulamine。此外白花丹素(plumbagin)是另一种AOS抑制剂,在0.5 mM时也能抑制Curvulamine的生成。至此,作者推断出了这个生物合成途径。见下图。
现在我们继续看谭老师这篇OL文章引用的自己课题组几篇文献(按照年份),以便我们更加了解植物共生菌。
2006的两篇文章
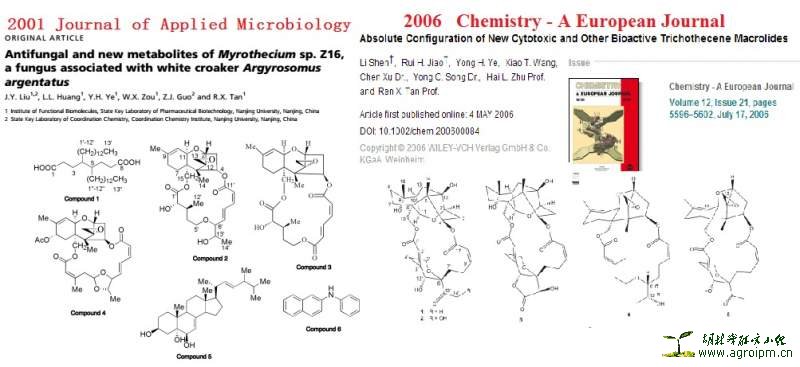
2008和2011以张应烙为第一作者出两篇大作Angew.Chem.和JACS。2011的JACS文章是在2008年发表的的Angew.Chem.的基础上(关于特境微生物-螳螂共生菌Daldinia eschscholzii研究),对该菌进行深入研究,从该菌中又发现了4类新骨架及6个新化合物,其中部分化合物具有很好的免疫抑制活性。


在以两篇大作的基础上,作者深层次研究发现了螳螂肠道真菌(Daldinia eschscholzii)产生的结构全新的Dalesconol类免疫抑制物及其独特的“异构体冗余现象”。随后该群体系统分析研究了该真菌的生物合成代谢通路及其关联性;在此基础上的深入研究发现Dalesconol类免疫抑制物是由不同的萘酚通过酚氧游离基耦合产生的,同时发现其“异构体冗余现象”现象很可能源于真菌漆酶引致的关键中间体优势构象。该成果不仅为此类免疫抑制物来源问题的解决奠定重要基础,而且为酚类合成生物学研究提供新的思路和概念。相关成果发表在Nature communications杂志(2012)。由于本人知识浅薄,对此部分内容不是很懂,相关报道可见文献原件(见附件)和相关网页。
(1.http://www.ebiotrade.com/newsf/2012-9/201291092724249.htm;2.http://www.escience.gov.cn/article/article_14576.html;3.http://edu.ifeng.com/gaoxiao/detail_2012_09/26/17918322_0.shtml。)















