读懂天然产物系列——抗生素
发布日期:2016-06-19 22:11
来源:网络
作者:网络
浏览次数:
以下文章转载自小木虫 swaucq
文献 Hamamoto, H.; Urai, M.; Ishii, K.; Yasukawa, J.; Paudel, A.; Murai, M.; Kaji, T.; Kuranaga, T.; Hamase, K.; Katsu, T.; Su, J.; Adachi, T.; Uchida, R.; Tomoda, H.; Yamada, M.; Souma, M.; Kurihara, H.; Inoue, M.; Sekimizu, K. Nat Chem Biol 8 December 2014; doi:10.1038/nchembio.1710
前言:
1836年6月,《货币战争》的主角,欧洲首富内森•罗斯柴尔德男爵不顾自己背部脓疮的疼痛,兴致勃勃地从伦敦奔赴德国法兰克福参加儿子的婚礼。不料,婚礼结束后,他的背部疼痛加剧,竟然至于卧床不起,当时德国最著名的外科医生对此都束手无策。很快,这位富可敌国的金融家就因细菌感染导致的败血症而不治身亡。这要是活在当下,即使是普通人,在最一般的医疗条件下,细菌感染都可以用抗生素治愈。这得益于自上世纪30年代以来,抗生素类药物大量发现所引发的医药行业伟大进步。此后,人类寿命大幅延长。然而,就在我们为自己在细菌感染治疗方面的成就而欢呼时,从上世纪70年代开始,细菌耐药性问题开始出现,并迅速蔓延。如今,很多国内医院临床一线分离到的病源耐药性菌所在比例早已超过50%。我们惊奇的发现,在这场和病源细菌,真菌的持久较量中,我们开始节节败退,寻找新的抗耐药性微生物的抗生素是如此紧迫,又步履维艰。
2014年,英国首相卡梅伦宣布,有三百年历史的英国皇家学会经度奖(奖金总额1000万英镑)面向全球开放申请,以期找到解决抗生素耐药性问题的对策。
这是一个好得不能再好,坏得不能再坏的时代,抗生素耐药性问题既是挑战,也是机遇。微生物与抗生素的斗争,是魔高一尺,还是道高一丈?所有的答案,还得从微生物中寻找……

研究背景:
目前临床上遇到的耐药性菌,主要包括耐甲氧西林金黄色葡萄球菌(MRSA)和多重耐药菌(MDR),前者是革兰氏阳性菌,后者则以革兰氏阴性菌居多。目前学者们的思路有:通过分析研究MRSA和MDR产生耐药性的机制,找到关键的靶点,通过寻找新化合物来抑制这个靶点(直接攻击);或者绕开这个靶点,寻找能攻击耐药菌新靶点的化合物(迂回包抄)两条。最近有不少这类文章。如Andrew M. King等学者以耐β内酰胺类抗生素的metallo-β-lactamases (MBLs)酶为靶点筛选到产自真菌的化合物Aspergillomarasmine A (AMA),与碳青霉烷烯类抗生素合用,能有效抑制耐β内酰胺类抗生素的革兰氏阴性病源菌(直接攻击,附件1)。Ching-Ming Chang等学者以控制肽聚糖合成的MurA酶为靶点筛选到产自曲霉的化合物Avenaciolides,能有效抑制MRSA病源菌(直接攻击,附件2)。Sascha Baumann等学者从粘细菌中分离到一类化合物Cystobactamids,作用靶点是细菌IIa 拓扑异构酶,能抗击MDR类耐药菌(迂回包抄,附件3)。然而,不管是直接攻击,还是迂回包抄,抗击耐药性菌的化合物作用靶点基本上都是以大分子(酶)为目标,下面这篇文章Lysocin e is a new antibiotic that targets menaquinone in the bacterial membrane(附件4,附件5)筛选出的化合物Lysocin E却是以小分子(甲基萘醌)为靶点,小分子作用于小分子,达到抗MASR的效果,甚为少见,此外,文章的家蚕筛选模型也引起我的极大兴趣。

研究内容
1. 筛选策略
作者采集了来自日本各地的14651份土壤细菌上清液样品,通过两轮高通量技术进行抗菌活性筛选,第一轮较常规的体外抗菌活性筛选,得到2794份(19%)样品,第二轮用了无脊椎动物家蚕感染模型进行筛选,得到23份(0.8%)样品,最后从23份样品活性的深入分析中,聚焦于菌株Lysobacter sp. RH2180-5。对Lysobacter sp. RH2180-5进行发酵,分离纯化,各个分离组分都在家蚕感染模型的活性指导下进行分离。最终得到化合物lysocin A-I ,其中lysocin E 是主要组分。


2. 结构解析
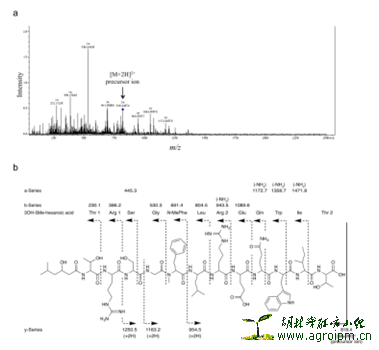
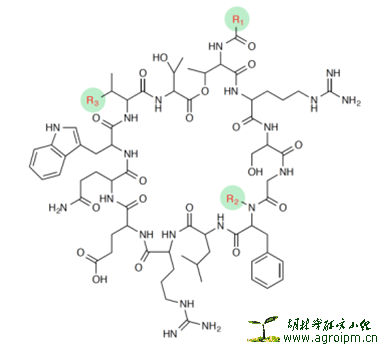
平面结构:作者从含量最大的lysocin E下手,用NMR1D和2D结合高分辨质谱技术,鉴定出其平面结构为环12肽并带3-OH-5-Me-hexanoic acid 支链。值得注意的是,日本学者在运用MS/MS串联质谱技术解析环肽,聚醚类分子量大,结构较复杂的化合物方面做的很好。作者从Thr1-碳位移偏低场,推测Thr1与Thr2是酯键相连,为印证此推测,作者分别用弱碱水解lysocin E成线性寡肽于普通水和O18标记水中,再加NaBH 4还原,分析其还原前后,标记与未标记的样品MS/MS高分辨质谱,证明Thr1与Thr2确实是酯键相连。

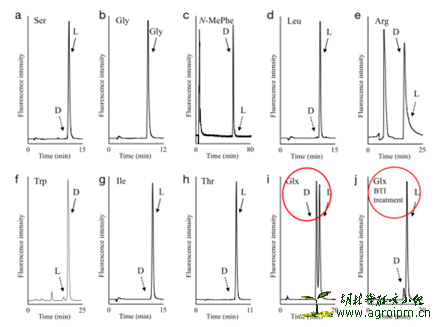
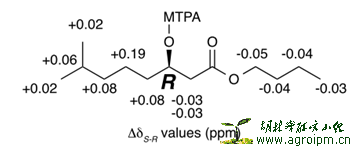
立体结构:环肽部分的绝对构型用2D-HPLC技术进行确定,其中为了区分Glu和Gln,用了赫夫曼重排,由于Glx在2D-HPLC中是L型和D型1:1出现的,赫夫曼重排将Gln转换成2,4-二氨基苯甲酸,2D-HPLC中只出现L型Glx,所以,Gln是D型,Glu是L型。3-OH-5-Me-hexanoic acid 支链部分3位绝对构型用Mosher反应来确定,是R型。
Lysocin A-I(除E外)的结构解析:作者对微量的化合物Lysocin A-I(E除外)结构,结合Lysocin E的结构已知的优势,运用高分辨MS/MS串联质谱技术,逐一解析了出来。

3. 靶点探寻
作者发现Lysocin E相对于庆大霉素,达托霉素,万古霉素有更强的致死性溶菌作用,推测Lysocin E作用位点在细胞膜上。通过钾离子渗漏和膜去极化实验,作者发现lysocin E诱导钾离子渗漏,膜电位快速下降和细菌细胞死亡,却对马和羊的红血球溶血作用很弱。这说明lysocin E 以一种特殊方式破坏MRSA的细胞壁膜,作者推测其作用靶点是特殊存在于细菌膜上的某一种分子。
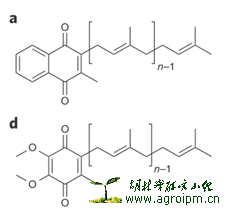
为了寻找与lysocin E抗菌活动相关的细菌基因,作者运用了温度-敏感-表型的抗性基因筛选实验。具体来说,就是以往一系列在抗生素耐药性上的经典实验证明,菌株对药物的抗性与温度-敏感-表型有关联。细菌群落中的耐药性温度敏感型菌株往往存在针对某一抗生素的基因突变。一旦针对某一抗生素的耐药性温度敏感菌株找到了,就可以通过寻找与温度敏感性相关的基因来找到耐药性相关基因。作者首先筛选到经过甲硫磺酸乙酯(诱发点突变的突变剂)处理的S. aureus RN4220温度敏感型突变菌株,这些突变菌株有耐lysocin E活性,再用来自野生型S. aureus RN4220菌株基因文库的基因进行回补,直到回补质粒涵盖的基因区域有menA开发阅读框时,温度敏感表型回复正常。基因分析表明,突变基因组在menA中存在点突变(G98A),导致一个氨基酸的G33D被取代。menA的产物参与甲基萘醌的合成,而甲基萘醌(下图左a)是细菌膜上呼吸电子传递链一种辅酶。
至此,作者研究重点放在了甲基萘醌上。MenA G33D点突变菌株脂质组分中甲基萘醌含量显著低于(40%)野生型菌株,且能通过回补menA基因恢复甲基萘醌含量,压制对lysocin E的抗性。噬菌体转导实验表明menA 基因点突变与lysocin E抗性相关联。作者进一步删除menA和menB(在menA上游,编码作用于甲基萘醌合成的酶)基因,发现菌株对lysocin E抗性,特别是破坏细胞膜的抵御能力显著增加。另一方面,阳性对照蜂毒肽是一种不依赖甲基萘醌的细胞膜破坏剂,能诱导突变菌株细胞膜钾离子渗漏。实验结果说明lysocin E的致死S. aureus是依赖甲基萘醌的。作者通过自发诱变筛选出耐lysocin E菌株,其甲基萘醌含量远低于野生型(<3%)。由于抗lysocin E突变株变现出生长缓慢的性状,作者想分析抗lysocin E与生长缺陷之间是否有联系。作者分析了野生型菌株在低温或者营养贫瘠条件下生长缓慢时对lysocin E抗性,发现没有抗性,这说明生长缓慢性状本身不能解释甲基萘醌突变株的lysocin E抗性。
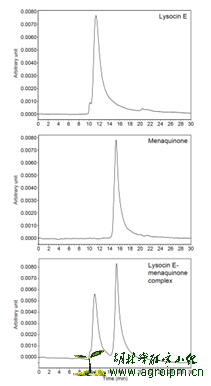
最后,作者想分析lysocin E与甲基萘醌在抑菌过程中是否存在相互作用。先外源性地添加甲基萘醌到S. aureus培养基,使得S. aureus对lysocin E的抗性呈现剂量性增加。加入泛醌(下图左b,哺乳动物呼吸链上辅酶),则对抗性没有影响。作者用微量量热法,直接分析lysocin E与甲基萘醌,lysocin E与泛醌相互作用的反应热,发现只有lysocin E与甲基萘醌存在共沉淀结合反应。作者通过凝胶过滤实验分析lysocin E与甲基萘醌结合体(下图右),当结合体溶于有机溶剂后,lysocin E和甲基萘醌都在HPLC中出峰,说明两者的结合是非共价作用。为了验证甲基萘醌与lysocin E的相互作用能破坏细胞膜,作者设计实验,先分别构建含甲基萘醌,不含甲基萘醌的人工脂质体,再利用lysocin E加入后,测量钙黄绿素的荧光值来衡量脂质体膜的破坏情况。结果表明,lysocin E选择性的破坏含甲基萘醌的脂质体膜。
在上述一系列严谨的论证实验基础上,作者得出结论:lysocin E的作用靶点是细菌原生质体膜中的甲基萘醌,其杀菌效应来源于依赖甲基萘醌的细胞膜破坏。
4. 活性分析
作者做了一系列小鼠实验,以万古霉素为阳性对照。发现lysocin E具有对哺乳动物毒性低,抗MRSA能力强的特点。
5 亮点分析
厚积薄发:这篇文章工作量极大,投入筛选的样品用了一万多份,而家蚕感染模型(作者前期实验论证了其模型相对于哺乳动物有高相似度,高效率的优点)和菌株温度-敏感-抗性表型两个经典实验背后,是这个课题组长期艰辛摸索建立起来的强大技术平台。在靶点的寻找和论证上,运用了逻辑性极强,层层推进的一系列生化分子实验,令人叹为观止。这体现的是课题组金字塔型的厚积薄发。
穷追猛打:不得不说,日本学者在结构解析上的功夫炉火纯青,大分子化合物先从含量大的下手,结合一些化学水解实验和高分辨MS/MS技术,把微量的其它同系列化合物一网打尽。把所有化合物的平面和立体结构通通解决了。在实验中不断假设,推理,论证,不达目的不罢休,才能成就这篇经典之作。
展望:这篇文章也有需进一步分析的问题。lysocin E依赖甲基萘醌破坏细胞膜,但是甲基萘醌的作用似乎占主导性,并不意味着其它辅助因子不存在。是否有大分子依然参与了破膜过程? 这个靶点的机理还有必要搞得更清楚。
启示:中国的幅员之辽阔远非日本能比,如果高通量筛选全国各地土壤样品,其出现抗MRSA化合物概率也应该高于日本。我国有世界最大家蚕种质资源库(西南大学),家蚕抗感染模型的建立也应该有很好的条件。我们中国科研军团在耐药性上的发展前景也很可期!
















