发布日期:2012-11-25 19:54 浏览次数:
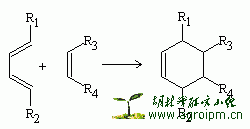
这个反应极易进行并且反应速度快,应用范围极广泛,是合成环状化合物的一个非常重要的方法。
带有吸电子取代基的亲双烯体和带有给电子取代基的双烯体对反应有利。常用的亲双烯体有:
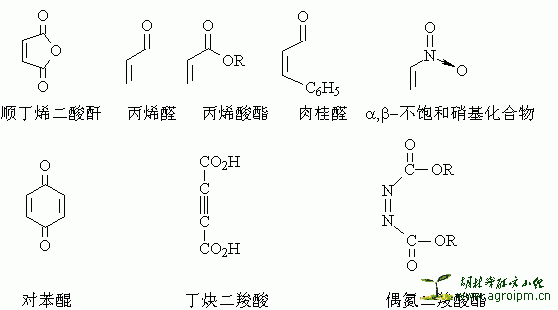
下列基团也能作为亲双烯体发生反应:
![]()
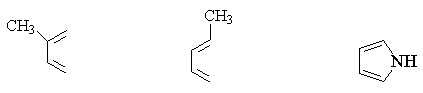
常用的双烯体有:
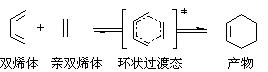
这是一个协同反应,反应时,双烯体和亲双烯体彼此靠近,互相作用,形成一个环状过渡态,然后逐渐转化为产物分子:
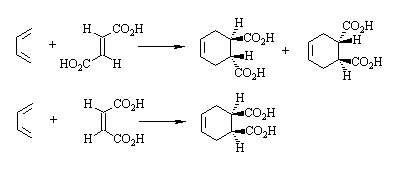
反应是按顺式加成方式进行的,反应物原来的构型关系仍保留在环加成产物中。例如:
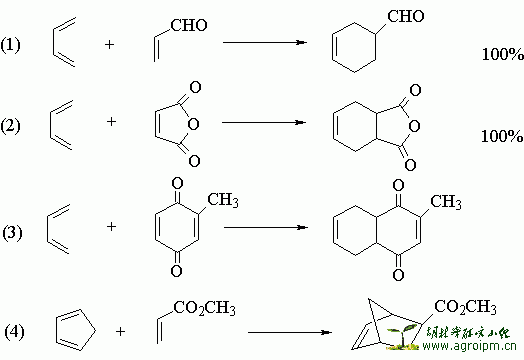
正常的Diels-Alder反应主要是由双烯体的HOMO(最高已占轨道)与亲双烯体的LUMO(最低未占轨道)发生作用。反应过程中,电子从双烯体的HOMO“流入”亲双烯体的LUMO。也有由双烯体的LUMO与亲双烯体的HOMO作用发生反应的。

本反应具有很强的区域选择性,当双烯体与亲双烯体上均有取代基时,主要生成两个取代基处于邻位或对位的产物:
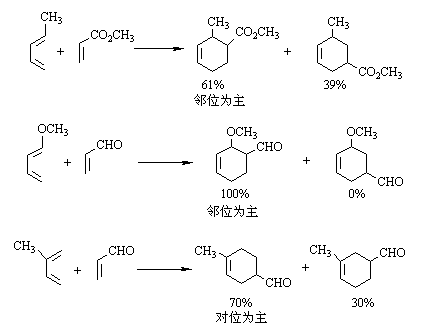
当双烯体上有给电子取代基、亲双烯体上有不饱和基团如:
![]()
与烯键(或炔键)共轭时,优先生成内型(endo)加成产物
[1] O. Diels and K. Alder, Ann., 460, 98 (1928); 470, 62 (1929) Ber., 62, 2081, 2087 (1929)
[2] J. A. Norton, Chem. Revs., 31, 319 (1942)
[3] M. C. Koetzel, Organic Reactions, 4, 1 (1948)
[4] H. L. Holmes, Organic Reactions, 4, 60 (1948)
[5] L. W. Butz, Organic Reactions, 5,136 (1949)
[6] Madronero, Rev. Scienc. Apl. (Madrid) 12, 397 (1958); C.A. 53, 6984 (1959)
[7] P. Yates and P. Eaton, J. Amer. Chem. Soc., 82, 4436 (1960)
[8] J. G. Martin and R K. Hill, Chem. Rev., 61, 537 (1961)
[9] G. I. Fray and R. Robinson, J. Amer. Chem Soc., 83, 249 (1961)
[10] L. F. Fieser and M. Fieser, Advanced Organic Chemistry (Reinhold, New York, 1961), pp 206-210
[11] S. B. Needlernan and M. C. C. Kuo, Chem. Rev., 62, 405 (1962)
[12] C. Walling and H. J. Schugar, J. Amer. Chem. Soc., 85, 607 (1963)
[13] S. Seltzer, J. Am. Chem. Soc., 85, 1360 (1963)
[14] W. J. Middleton, J. Org. Chem., 30, 1390(1965)
[15] J. B. Lambert, J. D. Roberts, Tetrahedron Letters, 1965, 1457.